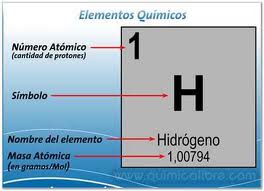
En los distintos modelos atómicos, los átomos se diferencian entre si por el numero de portones, neutrones y electrones que contienen cada uno. Generalmente para determinar el numero de estas partículas, se identifica el numero atómico que se representa con la letra (Z) y el número de masa que se representa con la letra (A).
Elementos químicos y Tabla Periodica
Hola en este blog les ayudare a que puedan relacionar las propiedades de los elementos químicos con el numero atómico, el numero de masa y también la interpretación de la tabla periódica.
lunes, 19 de marzo de 2012
Historia de la Tabla Periodica
Aquí les indico toda la historia de todo lo que tuvo que pasar la tabla para poder estructurarse.
Características generales de las familias de la tabla periódica
Hay 18 grupos los cuales son:
- Grupo 1(IA): los metales alcalinos (litio, sodio, potasio, rubidio, cesio, francio): todos estos tienen un electrón en su último nivel energético mas extremo, contundencia a desaparecer
- Grupo 2(IIA): los metales alcalinotérreos:(berilio, magnesio, calcio, estroncio, bario, radio) este último no siempre se considera, pues tiene un tiempo de vida media corta: tiene una configuración electrónica ns2, todos tienen solo 2 electrones en su último nivel de energía
- Grupo 3 al 12: los metales de transición, metales nobles, metales mansos o maleables: los metales de transición siempre terminan en el orbital d parcialmente lleno de electrones, los metales nobles son los que al mezclarse con otros compuesto no reaccionan o reaccionan muy poco, los metales maleables son muy dóciles y fáciles de manejar
- Grupo 13(IIIA): los metales térreos (boro, aluminio, galio, indio, talio): en su capa mas externa tienen tres electrones, forman iones de carga triple positiva (3+), menos el talio que lo hace con una carga monopositiva (1+)
- Grupo 14(IVA): los carbono ideos (carbono, silicio, germanio, estaño, plomo): al bajar en el grupo, estos elementos van teniendo características cada vez más metálicas
- Grupo 15(VA): los nitrogenados (nitrógeno, fosforo, arsénico, antimonio, bismuto): a alta temperatura son muy reactivos
- Grupo 16(VIA): anfígenos (oxigeno, azufre, selenio, telurio): el termino anfígeno significa formador de ácidos y bases, en su último nivel energético tiene 6 electrones
- Grupo 17(VIIA): los halógenos son elementos no metales
-Grupo 18(VIIIA): gases nobles tienen propiedades muy similares entre sí.
Tabla periódica
A lo largo del siglo XIX aumentó espectacularmente el número de los elementos químicos conocidos. Se comprobó, además, que entre algunos elementos existían notables semejanzas en sus propiedades químicas y físicas. Ante este hecho, y con objeto de presentar de modo racional los conocimientos de la Química, se creyó que podría ser muy útil ordenar los elementos de algún modo que reflejase las relaciones existentes entre ellos.
Tras varios intentos, en 1869 el químico ruso D. Mendeleiev presentó una tabla en la que aparecían los elementos distribuidos en filas y columnas, agrupados ordenadamente en diversas familias, siguiendo un orden creciente de masas atómicas.
En la actualidad esta tabla aparece bastante modificada, ya que se ordenan los elementos por orden creciente de número atómico. Dicha tabla, a la que llamamos Tabla Periódica o Sistema Periódico, es una expresión de las relaciones que existen entre los elementos químicos. Por eso, favorece su estudio y nos permite deducir muchas de sus propiedades con sólo saber su situación en ella.
Las 7 filas horizontales reciben el nombre de períodos y las 18 filas verticales o columnas se llamangrupos. Algunos de estos grupos tienen nombres especiales; así ocurre con el 16, los calcógenos(O,S,Se,Te); el 17, los halógenos (F,Cl,Br,I), o el 18, los gases nobles (He,Ne, Ar,...).
Tras varios intentos, en 1869 el químico ruso D. Mendeleiev presentó una tabla en la que aparecían los elementos distribuidos en filas y columnas, agrupados ordenadamente en diversas familias, siguiendo un orden creciente de masas atómicas.
En la actualidad esta tabla aparece bastante modificada, ya que se ordenan los elementos por orden creciente de número atómico. Dicha tabla, a la que llamamos Tabla Periódica o Sistema Periódico, es una expresión de las relaciones que existen entre los elementos químicos. Por eso, favorece su estudio y nos permite deducir muchas de sus propiedades con sólo saber su situación en ella.
Las 7 filas horizontales reciben el nombre de períodos y las 18 filas verticales o columnas se llamangrupos. Algunos de estos grupos tienen nombres especiales; así ocurre con el 16, los calcógenos(O,S,Se,Te); el 17, los halógenos (F,Cl,Br,I), o el 18, los gases nobles (He,Ne, Ar,...).
Suscribirse a:
Entradas (Atom)